ISO20387生物样本库CNAS认可服务
时间:2024-06-28 15:43:01 访问量:227生物样本库(Biobank)是采集、处理、储存生物样本及样本捐献者的临床数据和随访等相关信息的机构,生物样本包括离体的器官、组织、细胞、体液等。生物样本库为各类疾病基础和临床研究提供高质量的生物样本,同时在精准医学研究中扮演着重要的角色。
由于我国生物样本库发展时间较短,样本库标准化管理等方面尚在起步阶段,运营管理情况不容乐观,样本质量参差不齐,实际利用率较低,未来应进一步加强国内生物样本库的标准化管理能力。因此,建立相关运营和管理规范可有效加强生物样本库的管理和运行监管,促进其科学有序发展,使生物样本的有限投入发挥更大作用。
当前,CNAS已经建立生物样本库认可制度,采用国际标准ISO 20387《Biotechnology Biobanking General requirements for biobanking(生物样本库通用要求)》,是2018年8月由国际标准化组织正式发布的生物样本库认可体系。2019年8月30日,国家市场监督管理总局(国家标准化管理委员会)发布2019年第10号中国国家标准公告,批准GB/T 37864-2019《生物样本库质量和能力通用要求》(等同采用ISO 20387:2018)国家标准发布实施。
ISO 20387《生物样本库通用要求》国际标准于2019年8月正式发布。
北京智臻咨询 提供ISO20387生物样本库认可咨询服务。欢迎致电 咨询ISO20387生物样本库认可咨询服务。
ISO 20387生物样本库CNAS认可流程
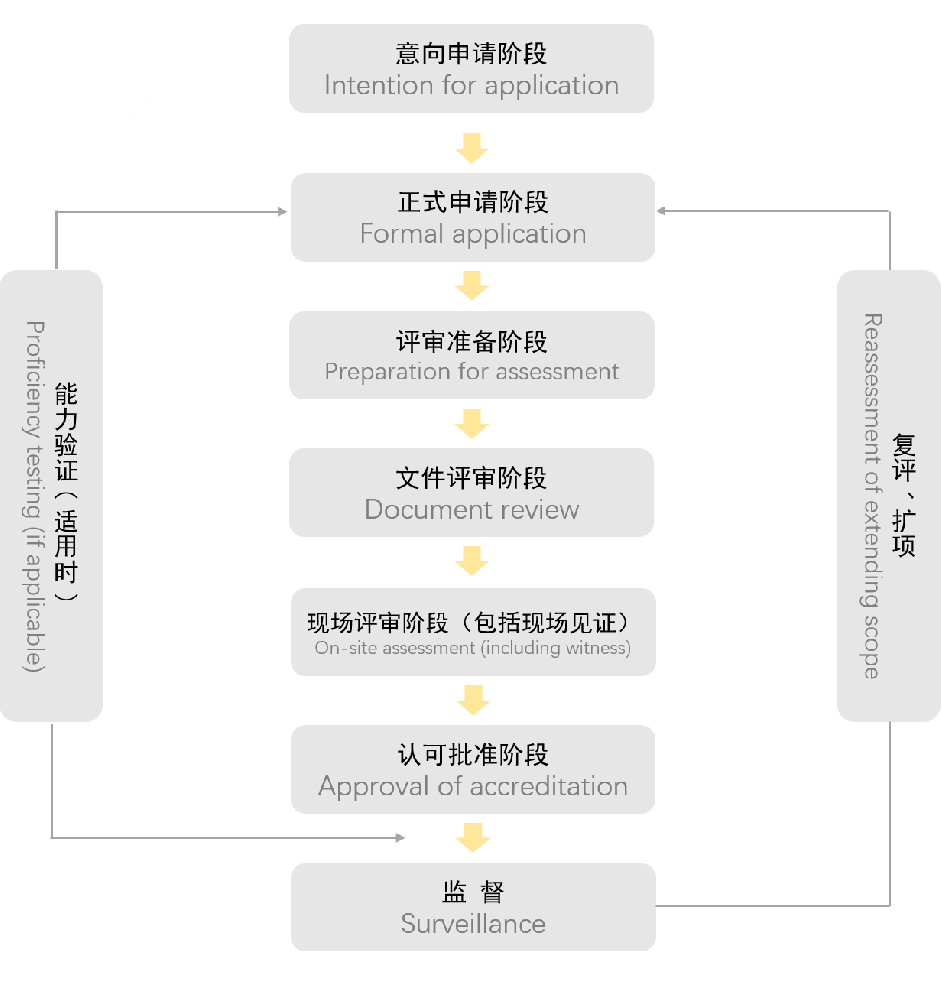
第一阶段:意向申请
申请人可以用任何方式向CNAS秘书处表示认可意向,如来访、电话、传真以及其他电子通讯方式。CNAS秘书处应向申请人提供最新版本的认可规则和其他有关文件。
第二阶段:正式申请
申请人应按CNAS 秘书处的要求提供申请资料,并交纳申请费用。CNAS秘书处审查申请人正式提交的申请资料,正式受理申请。
第三阶段:评审准备
CNAS秘书处以公正性和非歧视性的原则指定评审组,并征得申请人同意,如申请人基于公正性理由对评审组的任何成员表示拒绝时,秘书处经核实后应给予调整。
第四阶段:文件评审
评审组审查申请人提交的质量管理体系文件和相关资料,当发现文件不符合要求时秘书处或评审组应以书面方式通知申请人采取纠正措施。在申请人采取有效纠正措施解决发现的主要问题后,评审组长方可进行现场评审。
文件审查通过后,评审组长与申请人商定现场评审的具体时间安排和评审计划报CNAS秘书处批准后实施。
第五阶段:现场评审
评审组依据CNAS的认可准则、规则和要求及有关技术标准对申请人申凊范围内的技术能力和质量管理活动进行现场评审。
第六阶段:认可批准
CNAS 秘书处负责将评审资料及所有其他相关信息(如能力验证、投诉、 争议等)提交给评定委员会,评定委员会对申请人与认可要求的符合性进行评价并做出决定。经评定后,由秘书处办理相关手续。
CNAS向获准认可机构颁发有CNAS 授权人签章的认可证书,以及认可决定通知书和认可标识章,阐明批准的认可范围和授权签字人。认可证书有效期为6年。
第七阶段:监督评审
监督评审的目的是为了证实获准认可机构在认可有效期内持续地符合认可要求,并保证在认可规则和认可准则修订后,及时将有关要求纳入质量体系。所有获准认可机构均须接受CNAS的监督评审。监督评审包括现场监督评审和其他监督活动类型。
第八阶段:复评、扩项
获准认可机构应在认可批准后的每2年进行一次CNAS复评审。获准认可机构需要认可变更时,应在变更后一个月内以书面形式通知CNAS,CNAS在得到变更通知并核实情况后,视变更性质采取措施。
生物样本库获得CNAS认可的有益之处
1、通过标准化的要求,确保生物样本和数据的质量,表明生物样本库具备的基本的质量和能力,达到国家评定委员会的对应要求;
2、建立规范化的生物样本库质量管理体系,提高机构整体管理水平,提高机构整体素质和管理水平;
3、通过遵守国际标准提高机构竞争能力,提升机构形象,增强市场竞争能力,赢得政府部门,社会各界的信任;
4、通过定义、评估和控制风险,确保生物样本库的能力;
5、明确定义所有组织结构和管理的公正性、保密性,谨防数据的误用和泄露;
6、提高生物样本库安全管理(包括生物安全和生物安保)的能力,增强机构内部安全意识,保障生物样本库及人员安全;
7、实现生物样本库资源应用和共享,促进科研成果转化;
8、可在认可范围内使用CNAS 国家实验室认可标志,获得签署互动协议方国家和地区认可机构的承认,“一份报告发全球通行”,节省大量的时间、空间、人力、财力、物力;
9、表明具备了按照相应认可准则开展生物样本库的技术能力,检测结果获得国内外承认,并向客户展示具有保证良好的行为规范;
10、列入获准认可机构名录,提高样本库知名度;

版权所有 © 2008-2017 北京智臻管理咨询有限公司 技术支持:展为网络
Top

